Czy kiedykolwiek zastanawiałeś się, jak utrzymać wysokie standardy jakości i jednocześnie zmieniać procesy w wymagającym otoczeniu farmaceutycznym lub biotechnologicznym? W firmach zaliczanych do szeroko pojętego sektora life science – farmaceutycznych, medycznych czy biotechnologicznych – zarządzanie zmianą przybiera szczególne znaczenie. Przepisy, regulacje, standardy regulowane rozporządzeniem Dobrej Praktyki Wytwarzania (GMP) sprawiają, że każda modyfikacja procesu musi być nie tylko efektywna, ale też skrupulatnie udokumentowana i zgodna z ustalonymi wytycznymi.
W tym artykule spróbujemy pokazać, dlaczego samo zarządzanie zmianą jest kluczowe, jakich modeli możemy użyć, by osiągnąć sukces oraz dlaczego połączenie podejścia procesowego i ludzkiego (emocjonalnego) może okazać się dobrą ścieżką w branży life science. Przy okazji, zwrócimy uwagę na to, co w takich organizacjach bywa często zmorą – opór personelu i dylematy natury formalnej.
Dlaczego zmiana jest tak ważna w life science?
Zwykle, gdy słyszymy o zmianie, automatycznie mamy na myśli coś, co bywa trudne do przeprowadzenia. W przemyśle farmaceutycznym czy regulowanym ten proces wydaje się wręcz jeszcze bardziej złożony. Łatwo się domyślić, że jakakolwiek innowacja, modernizacja linii produkcyjnej lub nowa metoda kontroli jakości musi zostać zatwierdzona i udokumentowana tak, by spełniać wymogi regulatorów. Nie chodzi jedynie o nowe urządzenia, ale też o procedury, szkolenia pracowników, konfigurację systemów informatycznych czy nawet planowanie łańcucha dostaw.
Zgodnie z zasadami GMP (Good Manufacturing Practice), każda zmiana wymaga dokładnych analiz ryzyka, planów weryfikacji i solidnego nadzoru. Wyobraź sobie, że wprowadzasz nową maszynę do pakowania leków. Przecież musisz być pewien, że proces nadal będzie gwarantował odpowiednią czystość, stabilność produktu, a także spójność w całym cyklu produkcyjnym. Inna sprawa, że każda modyfikacja może budzić obawy wśród personelu – ludzie często wolą znane, działające procedury niż eksperymenty (nawet te obiecujące usprawnienia).
Dwa główne nurty w modelach zarządzania zmianą
Teoria zarządzania zmianą najczęściej dzieli się na dwie podstawowe kategorie:
- Modele skoncentrowane na procesie – czyli takie, które określają kroki, jakie trzeba podjąć, aby skutecznie przestawić organizację na nowe tory.
- Modele skoncentrowane na ludziach – skupione na sferze psychologicznej, na tym, jak pracownicy reagują na zapowiedź nowego porządku i jak ich prowadzić przez etap niepewności.
W firmach life science potrzebujemy obu podejść. Dlaczego? Bo sama procedura (np. zaktualizowanie dokumentacji GMP) nie wystarczy, jeśli zespół wciąż będzie odczuwał lęk przed zmianą. I odwrotnie – psychologiczne wspieranie ludzi nic nie da, jeśli zabraknie nam konkretnego planu i narzędzi do realnego wdrożenia.
Przyjrzyjmy się najpopularniejszym modelom, jednocześnie szukając dla nich miejsca w obszarze life science.
Modele procesowe
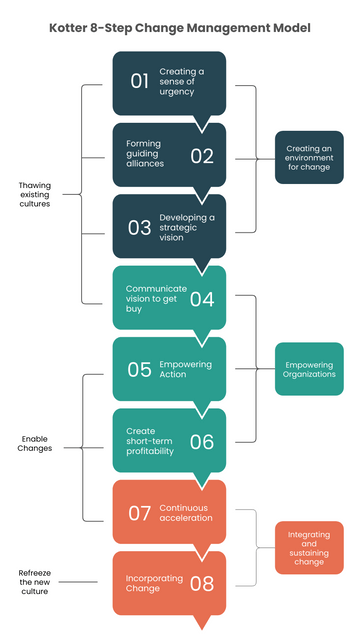
1. Model Johna Kottera (8 kroków)
John Kotter zaproponował ustrukturyzowane 8 etapów, które można rozumieć w trzech głównych fazach:
- Tworzenie klimatu dla zmiany (np. budowanie pilnej potrzeby zmiany, zjednoczenie wokół wspólnego celu).
- Angażowanie ludzi i umożliwienie działania (komunikacja wizji, usuwanie barier, świętowanie pierwszych sukcesów).
- Wdrażanie i utrwalanie (kontynuowanie wysiłków po początkowych zwycięstwach, zakorzenienie zmian w kulturze organizacji).
W praktyce life science, Kotter pomaga usystematyzować cały proces: od momentu, w którym zarząd uświadamia sobie potrzebę modyfikacji procedur (np. pod kątem nowej regulacji), przez etapy szkolenia personelu, aż po ostateczną aktualizację standardów dokumentacji i sprawdzenie, czy nawyki pracowników faktycznie się zmieniły.
Przykładowe wykorzystanie zmiany do wdrożeń w life science:
- Wdrażanie systemów elektronicznej dokumentacji (np. eBMR) w miejsce tradycyjnej papierowej, wymagające szeroko zakrojonej kampanii informacyjnej w firmie.
- Przeprowadzanie dużych projektów reorganizacji (łączenie komórek, zmiana hierarchii działów QC/QA).
- Przygotowanie pracowników do wprowadzenia nowych regulacji GMP czy zaleceń od krajowych i międzynarodowych instytucji nadzoru.
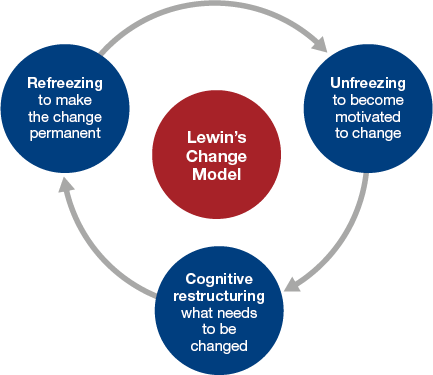
2. Model Kurta Lewina (rozmrożenie-zmiana-zamrożenie)
Kurt Lewin, ojciec współczesnego zarządzania zmianą, zaproponował klasyczne podejście:
- Rozmrożenie: wzbudzenie świadomości potrzeby zmiany oraz osłabienie przywiązania do aktualnego stanu.
- Zmiana: wprowadzanie nowych rozwiązań i przekształceń.
- Zamrożenie: ustabilizowanie nowego stanu rzeczy, żeby nie powrócono do starych zwyczajów.
W zakładach farmaceutycznych taki model bywa czytelny. Najpierw trzeba uzasadnić, czemu dotychczasowa metoda testowania próbek się nie sprawdza (czyli „rozmrozić” stare myślenie). Później wprowadza się zmodernizowaną procedurę kontroli, przeszkala personel, sprawdza dokumentację. Na koniec – aby wszystko nie wróciło do stanu wyjściowego – należy zadbać o trwałe „zamrożenie” zmienionego procesu (np. przez audyty, obserwacje i ścisłą kontrolę jakości).
Przykładowe wykorzystanie zmiany do wdrożeń w life science:
- Modyfikacja sposobu prowadzenia testów jakościowych w laboratoriach (od „oswojenia” personelu, przez wdrożenie, po utrwalenie nowych procedur).
- Migracja do nowej platformy IT – np. systemu do śledzenia reklamacji czy zarządzania wersjami dokumentów – wraz z fazą „rozmrożenia” starych nawyków.
- Zmiana struktury zespołów odpowiedzialnych za zgodność z regulacjami (compliance), tak aby sprawniej uwzględniać zapisy FDA i EMA.
3. Cykl PDCA (Plan-Do-Check-Act)
PDCA (znany również jako cykl Deminga, Deming Cycle) to w branży life science niemal chleb powszedni. Większość systemów skomputeryzowanych systemów jakości operuje właśnie zgodnie z tym cyklem. Popularność tego modelu wynika przede wszystkim z jego prostoty i wymagań, jakie stawiają jednostki regulacyjne odnośnie procesu zmian, czyli między innymi uwzględnieniu wpływu zmian i skutki skumulowanych zmian na jakość i bezpieczeństwo produktu końcowego. Jak wygląda ten 4-etapowy cykl?
- Plan: Zbadaj problem, przeanalizuj dane, zaplanuj nowe rozwiązania.
- Do: Przetestuj je na niewielką skalę (np. pilotaż).
- Check: Oceń wyniki i porównaj je z oczekiwaniami.
- Act: Jeśli uzyskane efekty są pozytywne, wdrażaj je szerzej. Jeśli nie, wróć do kroku Plan i popraw założenia.
Wykorzystanie PDCA sprzyja ciągłemu doskonaleniu – a to jest klucz w firmach farmaceutycznych, gdzie nieustannie testuje się metody i procesy. Przykładowo, po wprowadzeniu małej zmiany w protokole badań stabilności leku, zespół najpierw sprawdza jej skuteczność na małej próbie, po czym przechodzi przez kolejne etapy cyklu.
Przykładowe wykorzystanie zmiany do wdrożeń w life science:
- Ciągłe doskonalenie protokołów walidacyjnych w obszarze produkcji leków, dzięki cyklicznemu sprawdzaniu skuteczności zmian.
- Usprawnienie procesu zarządzania reklamacjami pacjentów i partnerów biznesowych poprzez ciągły pomiar i korekty podejścia.
- Doskonalenie procedur dokumentowania zatwierdzeń (np. związanych z testami stabilności) w krótkich iteracyjnych cyklach.
4. Ramy McKinsey 7S
Model McKinsey 7S uwzględnia aż siedem elementów, z czego niektóre są „twarde” (struktura, systemy, strategia), a inne „miękkie” (styl przywództwa, umiejętności, pracownicy i tzw. wspólne wartości). W branży life science przydaje się on wtedy, gdy zmiana jest kompleksowa: dotyczy nie tylko procesów produkcji czy jakości, lecz także relacji między zespołami, kultury organizacyjnej czy stylu zarządzania kierownictwa.
Zaletą modelu 7S jest pokazanie, że każda modyfikacja w jednym z obszarów wpływa na pozostałe. Jeśli modyfikujesz strukturę działu kontroli jakości, w konsekwencji będziesz musiał zająć się także narzędziami IT, stylem komunikacji, a może nawet polityką rekrutacyjną. Wszystko się łączy.

Przykładowe wykorzystanie zmiany do wdrożeń w life science:
- Tworzenie nowego działu ds. digitalizacji produkcji, aby zachować jednoczesną spójność strategii, struktury i stylu zarządzania.
- Przegląd zgodności kultury organizacyjnej z zasadami jakości i audytami (czy styl kierownictwa, systemy i umiejętności ludzi idą w parze z wymogami?).
- Analiza spójności struktury organizacyjnej z planami R&D, np. czy zasoby i kompetencje naukowe są we właściwym miejscu.
Modele skupione na ludziach
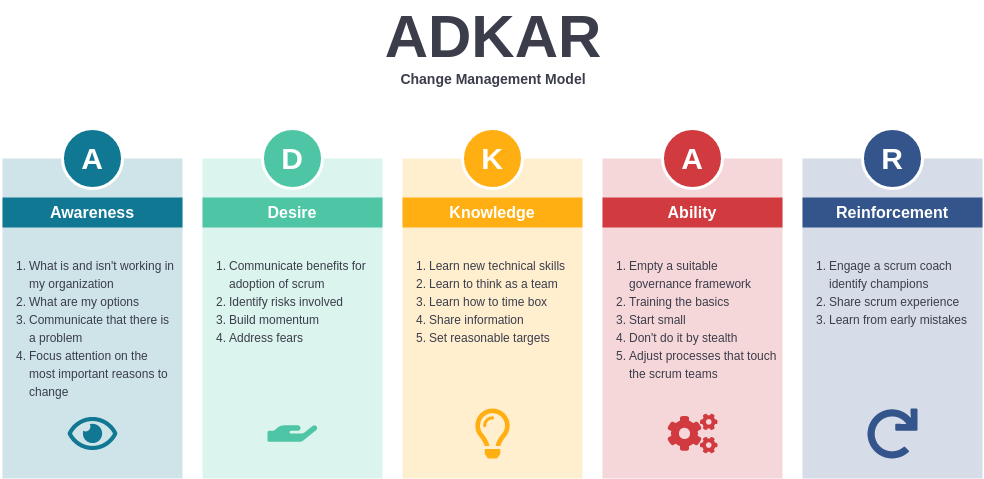
5. Model ADKAR (Awareness-Desire-Knowledge-Ability-Reinforcement)
ADKAR jest akronimem pięciu kroków, przez które musi przejść każda osoba, aby w pełni zaakceptować zmianę:
- Awareness (Świadomość) – Dlaczego trzeba coś zmienić?
- Desire (Chęć) – Czy pracownik chce się zaangażować?
- Knowledge (Wiedza) – Jak dokładnie ma to zrobić?
- Ability (Umiejętność) – Czy dysponuje faktycznymi kompetencjami do działania?
- Reinforcement (Wzmocnienie) – Czy środowisko wspiera i utrwala nowe postawy?
Kiedy w farmacji wdraża się np. nową procedurę walidacji sprzętu, to personel musi najpierw zrozumieć sens zmiany (Awareness), a później chcieć się w nią zaangażować (Desire). Następnie potrzebne są instrukcje i zasoby (Knowledge), by w praktyce potrafić przeprowadzać wymagane testy (Ability). Na końcu dobrze, gdy organizacja nagradza czy docenia osoby stosujące nowe rozwiązania (Reinforcement), aby nie porzucili nowego nawyku.
6. Nudge Theory
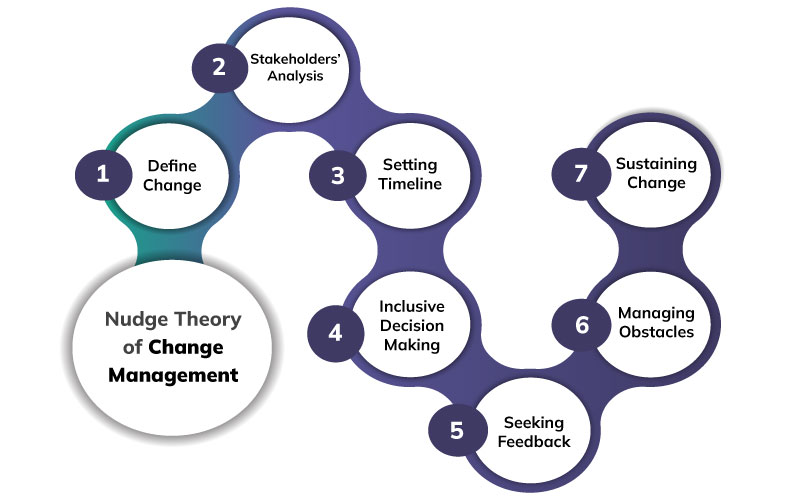
Teoria tzw. „szturchnięcia” mówi, że ludzi można delikatnie skłaniać do pożądanych zachowań, korzystając z ich naturalnych skłonności poznawczych i ograniczeń. Przykład? Wyobraź sobie, że chcesz, żeby pracownicy częściej pamiętali o higienie przy wejściu do sterylnej strefy produkcji. Zamiast pisać długie notatki, możesz umieścić wyraźne, sugestywne plakaty tuż przy drzwiach. Czasem drobne „przypomnienie” w kluczowym miejscu bywa skuteczniejsze niż najobszerniejsza prezentacja.
W kontekście farmaceutycznym nudge theory może przejawiać się np. w projektowaniu ścieżek komunikacyjnych w zakładzie, tak by najpierw było stanowisko z płynem dezynfekującym, a dopiero potem drzwi do działu. Dzięki temu nawet zapominalscy automatycznie wykonają właściwe czynności.
7. Model Satir
Początkowo stworzony z myślą o terapii rodzinnej, ale z powodzeniem używany również w organizacjach. Mówi o tym, że przy dużej, niespodziewanej zmianie większość ludzi przechodzi przez specyficzny „dołek” w efektywności, zanim zacznie adaptować się do nowej sytuacji.
Chodzi o to, że najpierw pojawia się etap status quo, potem coś nas „wytrąca z równowagi” i występuje chwilowe pogorszenie. Dopiero wtedy, jeśli zostanie zapewnione odpowiednie wsparcie i zrozumienie, następuje „przebudowa” i końcowa poprawa wydajności. Dla zespołów w laboratoriach lub na liniach produkcyjnych świadomość istnienia takiej krzywej bywa kojąca: widzą, że chwilowy spadek wyników jest normalny, a potem wyniki rosną, gdy wszyscy oswoją się z nowym systemem.

8. Model przejścia Williama Bridgesa
Bridges uważa, że zmiana jest procesem, który da się opisać w trzech fazach:
- Zakończenie (Ending) – pożegnanie się z tym, co stare i oswojone.
- Strefa neutralna (Neutral Zone) – moment niepewności, kiedy stare już nie działa, a nowe jeszcze się nie ugruntowało.
- Nowy początek (New Beginning) – faza, kiedy ludzie faktycznie angażują się w nowy porządek.
Można to odnieść do sytuacji, w której firma przechodzi z papierowej dokumentacji produkcyjnej na elektroniczny system zarządzania partiami (tzw. eBR). Najpierw trzeba pomóc ludziom pożegnać się z drukowaniem setek stron i ręcznym podpisywaniem (Zakończenie). Potem pojawia się chaos i pewien niepokój, bo wszyscy uczą się, jak obsługiwać system, a jednocześnie muszą pamiętać o regulacjach GMP (Strefa neutralna). Gdy już zespół ogarnie nową technologię, a działania zostaną ustabilizowane, firma faktycznie zaczyna odczuwać korzyści (Nowy początek).
9. Krzywa zmiany (Change Curve)
Często przedstawiana jako emocjonalny wykres reakcji na zmianę. Mówi się, że wiele osób przechodzi przez etapy szoku, zaprzeczenia, złości, a potem prób akceptacji i w końcu faktycznego pogodzenia się z nową sytuacją. W farmacji może to dotyczyć np. reorganizacji działu R&D. Osoby, które były przyzwyczajone do „od zawsze” istniejącej struktury, muszą teraz odnaleźć się w innym układzie ról i odpowiedzialności.
Wiedza o krzywej zmiany pomaga kierownikom wyczuć momenty, gdy pracownicy szczególnie potrzebują wsparcia, a kiedy można już przejść do intensywniejszych szkoleń lub przydzielania nowych obowiązków.
10. Model Trzech Poziomów Oporu (Maurer’s Three Levels of Resistance)
Maurer mówi o tym, że opór przeciwko nowym rozwiązaniom ma trzy „piętra”:
- Brak zrozumienia („Nie pojmuję, czemu musimy to robić”), czyli niedostatek informacji.
- Brak akceptacji („Nie podoba mi się to”), czyli emocje związane z obawą, że zmiana przyniesie coś niekorzystnego.
- Brak zaufania („Nie wierzę, że ty – lider – to dobrze zrealizujesz”).
W branży life science to bardzo trafne rozróżnienie: czasem opór może wynikać z faktycznego niedoinformowania (np. dlaczego wprowadzamy droższe surowce), czasem z emocjonalnej reakcji na potencjalnie trudniejsze procedury, a czasem z obaw wobec kompetencji przełożonych czy koordynatorów projektu. W zależności od poziomu, konieczne jest inne podejście.
Czy można mieszać różne modele?
Oczywiście. Modele zarządzania zmianą nie są regułami wykutymi w kamieniu. Można śmiało łączyć elementy procesowe, jak PDCA, z podejściem psychologicznym, na przykład z ADKAR. W firmach farmaceutycznych takie hybrydowe podejście jest często wręcz koniecznością, bo realia regulacyjne wymagają konkretnego planu wdrożenia (zobrazowanego np. przez kolejne etapy Kottera), a pracownicy potrzebują jasnego wsparcia na poziomie emocjonalnym i wiedzy (co zapewnia np. ADKAR).
Przy wprowadzaniu zmiany pamiętajmy też o formalnych kryteriach, takich jak ocena ryzyka, dokumentacja zgodna z GMP czy walidacja procesów. Stosowanie cyklu PDCA pomoże utrzymać ciągłą kontrolę i powtarzalne wyniki, a jednocześnie – gdy połączymy to z teoriami oporu, np. trzema poziomami Maurera – dowiemy się, w którym momencie nasi pracownicy najbardziej potrzebują informacji, szkoleń lub dodatkowych konsultacji.
Kontekst technologiczny i nie tylko
Czasem wprowadzając nowy system komputerowy do rejestracji wyników z laboratorium, mamy tendencję do skupiania się na aspektach czysto technicznych. Czy serwer wytrzyma obciążenie? Czy narzędzie zintegrowano z systemem ERP? Jednak w sektorze life science równie ważne jest, by zespół rozumiał, dlaczego akurat taki system wdrażamy. Bez zbudowania świadomości (pierwsze A w ADKAR), ludzie będą traktować go jako kolejny narzucony obowiązek, a nie realne wsparcie codziennej pracy.
Warto czasem zapytać: „Jak się z tym czujecie?” albo „Czy macie wątpliwości co do nowej procedury testowej?” – i to nie po to, by się wycofać, ale żeby zawczasu zareagować na sygnały alarmowe. Pamiętajmy, że w wypadku zmiany technologicznej – zwłaszcza w warunkach laboratoryjnych czy produkcyjnych – każda pomyłka może przerodzić się w poważne koszty lub ryzyko dla pacjentów.
Krótka dygresja o kulturze organizacyjnej
Firmy farmaceutyczne często są bardzo sformalizowane i hierarchiczne. Można to zrozumieć, bo regulacje wymuszają ścisłe procedury, rejestry, kontrole. Jednak zbyt „sztywna” struktura potrafi utrudniać wprowadzanie nowości, bo wszystko wymaga szeregu akceptacji, a każda odstępstwo budzi obawy.
Dlatego tak ważne jest tworzenie atmosfery otwartości na usprawnienia. Niech ludzie wiedzą, że jeśli zobaczą potencjał do poprawy, mogą to zgłosić bez obaw o reprymendę. W końcu najprzyjemniejsze jest wtedy, gdy to sami pracownicy przynoszą pomysły na mniejsze lub większe udoskonalenia, a firma reaguje na to z entuzjazmem.
Podsumowanie
Zarządzanie zmianą w branży life science to często wyzwanie natury organizacyjnej, prawnej i psychologicznej. Wymaga jednocześnie znajomości wytycznych GMP, umiejętności tworzenia przejrzystych planów działania oraz zrozumienia ludzkich reakcji na nowość. Bez odpowiedniej troski o czynnik ludzki nawet najbardziej szczegółowa procedura może zostać odrzucona lub źle zrealizowana. Z kolei bez porządnych fundamentów procesowych i dokumentacyjnych żadna zmiana nie utrzyma się w firmie obarczonej tak wieloma regulacjami.
Czy chcesz wprowadzić coś nowego w swojej organizacji, ale martwią Cię możliwe trudności i obawy pracowników? A może planujesz modyfikację procedur i zastanawiasz się, jaki model zarządzania zmianą zastosować? W obu przypadkach przyda się przemyślane podejście. Łącz procesowe metody (Kotter, Lewin, PDCA) z ludzkim wymiarem (ADKAR, nudge theory, Bridges, Satir). Następnie uwzględnij szczególne wytyczne dotyczące rejestracji i walidacji, tak istotne w life science.
Jeżeli szukasz wskazówek lub wsparcia we wdrażaniu zmian w Twojej firmie farmaceutycznej, biotechnologicznej albo medycznej, zapraszamy do kontaktu. Zajmujemy się wprowadzaniem zmian kompleksowych i pomniejszych a także narzędzi do zarządzania zmianami.
Przekujmy idee w efektywne i sprawdzone działania, dbając równocześnie o wymogi regulacyjne oraz komfort pracowników.

